地拉羅司
 | |
 | |
| 臨床資料 | |
|---|---|
| 读音 | de FER a sir ox |
| 商品名 | 易解铁(Exjade)、Asunra、Asunra及解铁定(Jadenu)等 |
| 其他名稱 | CGP-72670, ICL-670A, IC L670 |
| AHFS/Drugs.com | Monograph |
| 核准狀況 |
|
| 懷孕分級 |
|
| 给药途径 | 口服給藥 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物利用度 | 70% |
| 血漿蛋白結合率 | 99% |
| 药物代谢 | 肝臟葡糖苷酸化 |
| 生物半衰期 | 8-16小時 |
| 排泄途徑 | 糞便 (84%)及尿液 (8%) |
| 识别信息 | |
| |
| CAS号 | 201530-41-8 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.211.077 |
| 化学信息 | |
| 化学式 | C21H15N3O4 |
| 摩尔质量 | 373.37 g·mol−1 |
| 3D模型(JSmol) | |
| 密度 | 1.4±0.1 g/cm3 [1] |
| |
| |
地拉罗司(INN:deferasirox)是一種口服鐵螯合治療藥物,於市面銷售的品牌中,有諾華公司在不同國家生產的Exjade、Asunra和Oleptiss(均為片劑)。其主要用途是減少因罹患β型地中海貧血和其他慢性貧血等疾病的患者,因需長期接受輸血而造成的血色沉著病。[2][3]此藥物是第一種於美國受到批准用於前述目的的藥物,以口服方式給藥。[4]
地拉罗司於2005年11月獲得美國食品藥物管理局(FDA)核准用於治療β型地中海貧血。[2][4]根據FDA (2007年5月) 的數據,接受地拉罗司治療的患者中出現腎功能衰竭和成熟血球數量減少的報告。此藥物於2008年在歐盟獲得歐洲藥品管理局 (EMA) 批准,用於治療六歲及以上兒童因連續輸血而導致的慢性血色沉著病。[5][6][7]地拉罗司已被列入世界衛生組織基本藥物標準清單中。[8]
梯瓦藥業於2020年7月決定停止生產地拉罗司。[9]此藥物有通用名藥物於市面流通。[10]
屬性[编辑]
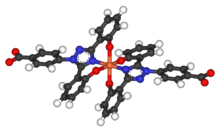
地拉罗司進入人體後的生物半衰期為8至16小時,因此每天只需給藥一次。[11]兩個分子的地拉罗司能與1個鐵原子結合,之後透過糞便排出人體。其具有的低分子量和高親脂的特性讓該藥物可用口服方式攝取,不像有類似功能的去鐵胺須透過靜脈注射給藥。地拉罗司與去鐵酮聯合使用,似乎能從細胞(心肌細胞和肝細胞)中以及從血液中將鐵去除。[12]
合成[编辑]
地拉罗司可由市面既有的簡單原料(水楊酸、水楊醯胺和 4-肼基苯甲酸(4-hydrazinobenzoic acid))依照兩步合成順序製備。[13]

風險[编辑]
根據非營利組織安全醫療實踐研究所編制的2019年疑似導致患者死亡的藥物名單中,與地拉罗司相關的死亡人數為1,320例,排名第二。[14]於同年,該藥物的標籤中被要求加上可能會導致腎功能衰竭、肝衰竭和消化道出血的黑框警告。[15]疑似導致死亡人數激增的主要原因是因為諾華重新分析不良事件數據後而得的結果。[14]
參見[编辑]
- ^ Material Safety Data Sheet (MSDS): Deferasirox. ChemSrc. 2018.
- ^ 2.0 2.1 Choudhry VP, Naithani R. Current status of iron overload and chelation with deferasirox. Indian Journal of Pediatrics. August 2007, 74 (8): 759–64. PMID 17785900. S2CID 19930076. doi:10.1007/s12098-007-0134-7. Free full text 互联网档案馆的存檔,存档日期2014-04-29.
- ^ Yang LP, Keam SJ, Keating GM. Deferasirox : a review of its use in the management of transfusional chronic iron overload. Drugs. 2007, 67 (15): 2211–30. PMID 17927285. S2CID 195686285. doi:10.2165/00003495-200767150-00007.
- ^ 4.0 4.1 FDA Approves First Oral Drug for Chronic Iron Overload (新闻稿). United States Food and Drug Administration. 2005-11-09 [2007-10-31].
- ^ Exjade – deferasirox (PDF). European Medicines Agency. 2018 [2012-11-26]. (原始内容 (PDF)存档于2017-12-29).
- ^ Kontoghiorghes GJ. Turning a blind eye to deferasirox's toxicity?. Lancet. April 2013, 381 (9873): 1183–4. PMID 23561999. S2CID 27794849. doi:10.1016/S0140-6736(13)60799-0
 .
.
- ^ Review: Exjade side effects. [2013-04-20]. (原始内容存档于2016-03-04).
- ^ World Health Organization. The selection and use of essential medicines 2023: web annex A: World Health Organization model list of essential medicines: 23rd list (2023). Geneva: World Health Organization. 2023. hdl:10665/371090
 . WHO/MHP/HPS/EML/2023.02.
. WHO/MHP/HPS/EML/2023.02.
- ^ Deferasirox Discontinuation. U.S. Food and Drug Administration (FDA). [2020-07-20].
- ^ Drugs@FDA: FDA-Approved Drugs. U.S. Food and Drug Administration. [2020-08-15].
- ^ Al-Rousan, Rabaa M.; Manzoor, Kamran. Long-Term Efficacy of Deferasirox in Preventing Cardiovascular Complications in the Iron-Overloaded Gerbil. Journal of Cardiovascular Pharmacology and Therapeutics. 2011-05-18 [2024-04-09]. doi:10.1177/1074248411407635.
- ^ Salem, Ahmed; Desai, Payal. Cureus https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10695738/. November 2023, 15 (11) [2024-04-09]. 缺少或
|title=为空 (帮助) - ^ Steinhauser S, Heinz U, Bartholomä M, Weyhermüller T, Nick H, Hegetschweiler K. Complex Formation of ICL670 and Related Ligands with FeIII and FeII. European Journal of Inorganic Chemistry. 2004, 2004 (21): 4177–4192. doi:10.1002/ejic.200400363.]
- ^ 14.0 14.1 QuarterWatch™ (Quarter 4 and 2009 totals): Reported Patient Deaths Increased by 14% in 2009. Institute For Safe Medication Practices. [2021-06-28] (英语).
- ^ Pediatrics, American Academy of. Black box warning added to Exjade. AAP News. 2010-02-19 [2021-06-28]. ISSN 1073-0397. doi:10.1542/aapnews.20100219-1 (不活跃 31 January 2024). (原始内容存档于2021-06-28) (英语).
| ||||||||||||||||||||||||||||||||||
